
| Aktualisierungsvermerk: 14.03.2006, neu sind: Kap. 9.2.2 -9.2.4,
9.3, 9.4, 10 Jan. 2007: neu ! Wissenstest: Übungen in Form von Fragen und Antworten mit Visualisierungen (z.T. noch in Englisch) siehe Inhalt Pos. 13 !!! Jan. 2009: Mindmap-Darstellung für eine 'andere' Art von Überblick. Feb. 2009 ein 'Mops' in Kap. 9.2.4. wurde beseitigt (falsch: AIK statt richtig KIK) ein paar Erklärungen zugefügt. Es ist geplant, aktuelle pdf-Einzeldateien der 4 Teile anzubieten. |
Benützen Sie diese Übersicht vor allem dazu, zu überprüfen, was Ihnen bekannt ist, bzw. wo Sie 'Nachholbedarf ' haben.
<<<< Rand verschieben !!!
 |
Mindmap aufklappen ----> Bild-Click!!! (mit Browser-Back zurück !!)
In Kürze geht's weiter !!
Das Fach 'Chemische Reaktionstechnik' (engl. 'chemical reaction engineering) ist ein typisches Grenzgebiet, also 'interdisziplinär'. Es ist angesiedelt zwischen der Chemie und dem Ingenieurwesen. Die Fachgebiete sind (in Deutschland) die 'Technische Chemie' bei der Chemie ( dies ist salopp gesagt ein Abkömmling der Physikalischen Chemie) und beim Ingenieurwesen das 'Chemische Verfahrens-Ingenieur-Wesen'. Im englischen wird das gesamte Grenzgebiet 'chemical engineering' genannt.
Die Chemische Reaktionstechnik befasst sich im Gegensatz zur Chemischen
Verfahrenstechnik speziell nur mit der 'Ausführung' chemischer
Reaktionen in technischen Reaktionsapparaturen. Chemische
Verfahrenstechnik allgemein befasst sich dagegen z.B. auch mit den sogenannten
Grundoperationen der apparativen Prozesse in der Chemie, wie z.B.
Extrahieren, Destillieren, Verdampfen, Kristallisieren, Sieben, Mahlen u.v.a.
(mechnische und thermische Grundoperationen genannt).
Die Chemische
Verfahrenstechnik ist ihrerseits wiederum ein Teilgebiet der (allgemeinen)
Verfahrenstechnik (beliebiger technischer Prozesse), - nämlich das Gebiet,
das sich nur mit chemischen Prozessen und Apparaten befasst. Ein
Teilgebiet der Chemischen Verfahrenstechnik ist wiederum zum Beispiel der
Chemische Apparatebau, aber eben auch neben
Prozeßtechnik/Prozeßkunde und anderen Disziplinen die Chemische
Reaktionstechnik.
Als interdiszplinäres Fach erfordert die Chemische Reaktionstechnik
grundlegende Kenntnisse über die in den Anlagen zur Anwendung kommenden
Chemischen Reaktionen - also grob auf einen Nenner gebracht die Kenntnisse
des Chemikers - sie erfordert aber andererseits auch technische
Grundkenntnisse.
Lehre und Ausbildung zur Chemischen Reaktionstechnik
sind in Deutschland etwas häufiger an den Chemie-Fakultäten, vor
allem an Technischen Universitäten (früher oft TH = Technische
Hochschule), angesiedelt als bei den Ingenieur-Fakultäten.
Kenntnisse
zu diesem Fachgebiet sind jedoch gerade für Chemische Verfahrenstechniker
unabdingbar, - denn wie soll ich einen Apparat entwickeln, wenn
ich nicht begreife, was in diesem eigentlich abläuft. Hier besteht
also ein 'Lehr-Exportpotenzial' der Chemie.
Bei Chemikern, die später
in der Industrie im Betrieb arbeiten wollen (es gibt nicht nur Labor-Jobs, oder
besser: relativ wenige Labortätigkeiten !!), sind Kenntnisse in diesem
Metier ebenfalls dringend erforderlich, denn wie soll er (der Chemiker)
mit dem Ingenieur über reaktionstechnische Probleme in der Anlage
diskutieren, wenn er überhaupt nichts davon versteht ? - und glauben
Sie mir, das ist bei Chemikern gar nicht so selten!!!
Für Neulinge würde ich nach meiner Erfahrung eine parallele Einarbeitung in meinen vorliegenden Kurs und das Buch Literatur-Aufstellung 6.) 'Reaktionstechnik...' von J. Hagen empfehlen - mit einer anschließenden Vertiefung in die anderen Bücher, da diese schon etwas höhere Anforderungen an die mathematischen und physikochemischen Kenntnisse stellen.
Die Chemie befasst sich mit dem 'Wesen' der Chemischen Reaktion, die Reaktionstechnik mit der 'Berechnung'/'Auslegung' und Entwickulung der Apparate und des 'umgebenden' Prozesses. |
Kann man nicht einfach sagen 'es gibt ein bis drei grundsätzliche Typen von chemischen Reaktionen' und die Wahl und Auslegung der Reaktionsapparate läuft dann in ebensoviel Typ-Kategorien ab und alles läuft nach Schema F ! Bei dieser provokanten Formuliereung kann sich der Leser schon denken: so einfach ist das nicht !! Nun was wissen wir als Laien über den Ablauf chemischer Reaktionen ? Ein Kanonenschlag an Silvester ist eine explosive chemische Reaktion, sie läuft nach unserer Beobachtung 'sehr' schnell ab. Das Aushärten eines Epoxidklebers, wie z.B. Uhu-Plus, dauert mehr als eine Stunde und man verzweifelt schier bis das Zeugs aushärtet. Die Zeit spielt also eine große Rolle, es gibt Reaktionen mit verschiedenster Schnelligkeit. Mit dem zeitlichen Verlauf chemischer Reaktionen befasst sich die Physikalische Chemie, - das Gebiet wird chemische Reaktionskinetik genannt (Kinetik ist grob gesagt der Zeitablauf dynamischer Prozesse, also beispielsweise durchaus auch rein physikalischer Vorgänge). Wir können uns dann mit unserem gesunden Menschenverstand herleiten: wenn ich eine schnelle Reaktion habe, setzt sich pro Zeiteinheit mehr Stoff um, beispielsweise zu einem gewünschten Endprodukt, als bei einer langsamen Reaktion, - sagen wir mal vorsichtigerweise 'unter sonst vergleichbaren Bedingungen', - wir erhalten dann bei geschicktem 'Handling' pro Zeiteinheit mehr Produktmenege -> und schon sind wir bei einem sehr bedeutsamen reaktionstechnischen Begriff angelangt, der 'Spezifischen Produktleistung'. Spezifische Produktleistung sagt aus, wieviel Menge eines bestimmten Produkts pro Zeiteinheit in einem Reaktionsraum, also pro Reaktorvolumen, gewonnen werden kann ( z.B. Tonnen Ammonsulfatsalpeter pro Jahr = Jato je m3 Reaktor, oder aber auch beispielsweise nur kg/(min.l) Ammonsulfatsalpeter). Aus den oben vorsichtig getroffenen Einschränkugen kann man erraten, daß es außer der 'Schnelligkeit' noch andere Einflußgrößen gibt, die die Spezifische Produktleistung beeinflussen. Ein wichtiges Beispiel soll Ihnen schon hier nicht vorenthalten werden. Es gibt Reaktionen, die mehrere Produkte erzeugen, deren relativer Anteil von vielen Parametern abhängen kann. Man spricht hier von einem Selektivitätsproblem. Unter Selektivität versteht man den Anteil eines gewünschten Produktes im Verhältnis zu verbrauchten Einsatzstoffen (und damit auch zur Menge des entstandenen Konkurrenzprodukts). Sie verstehen jetzt vielleicht schon eher, warum im Titel und im folgenden Statement der salomonische Begriff 'Wesen der Reaktion' gewählt wurde.
Die Spezifische Produktleistung einer Reaktion in einem Reaktionsapparat (Reaktor genannt) hängt vom 'Wesen' (insbesondere der 'Schnelligkeit', aber eben z.B. auch der Selektivität) der chemischen Reaktion ab. |
Ohne zunächst auf weitere Feinheiten, wie Umsatz, Ausbeute, Selektivität und auch Stofftransprotphänomene näher einzugehen, soll uns dies als ausreichendes Argument für die Bedeutung des 'Wesens' der Chemischen Reaktion genügen.
Technische Prozesse können absatzweise und stetig verlaufen. Absatzweise bedeutet, daß
der Prozeß gestartet wird und in einer gleichbleibenden räumlichen
Umgebung solange abläuft, bis er aus irgenwelchen Gründen
aufhört, - sei es von sich selbst aus oder durch erzwungenes Abstoppen.
Danach muß ein neuer Prozess gestartet werden (ein Schreiner fertigt
einen Bauernschrank an, so schön Stück für Stück. Wenn der
Schrank fertig und verkauft ist, kommt der nächste dran oder aber auch
ganz etwas anderes). Bei stetig verlaufenden Prozessen werden dem Prozess
laufend 'Resourcen' zugeführt, diese werden innerhalb des stetig
verlaufenden (oder auch 'kontinuierlichen') Prozesses immer gleichartig
zu irgenwelchen Produkten verarbeitet, die den Prozess dann stetig
(kontinuierlich) verlassen (in einer Möbelfabrik wird an einem Band immer
der gleiche Sessel produziert, am Ende werden die Sessel vom Band genommen und
gestapelt, das geht ununterbrochen so, bis irgendetwas kaputt geht oder keiner
mehr so einen Sessel haben will. ). Kontinuierliche Produktionsweisen sind
meist eleganter und leistungsfähiger. Dinge, wie z.B. das 'Aufräumen'
und 'Wiederherstellen des Produktionsausgangszustandes' bei absatzweisen
Prozessen entfallen. Die Prozess-Regeltechnik wird oft effizienter. Die
spezifische Produkt(ions)leistung ist auf jeden Fall höher.
Es soll an
dieser Stelle aber nicht verschwiegen werden, daß es in der
Prozesstechnik auch Mischungen aus beiden Betriebsweisen gibt (manchmal auch
Schaltungen oder Verschaltungen genannt, - wie in der Elektrotechnik - und auch
weitreichend analog dazu !!) , - so vor allem den 'Teilfließbetrieb', bei
dem absatzweise Prozesse parallel oder in Serie oder mit Überlappung
verschaltet ablaufen ('Batteriebetrieb', 'Revolverwechselvorrichtungen' u.v.a.:
der eine Reaktionsapparat wird neu befüllt während der andere gerade
'Reaktion durchführt' und ein dritter gerade entleert wird). Diese
Schaltungen können selbstverständlich auch echt kontinuierliche
Objekte als Elemente enthalten, - die Verschaltung wird dann eventuell ziemlich
kompliziert.
In der chemischen Reaktionstechnik unterscheidet man in gleicher Weise wie in der allgemeinen Prozeß-Verfahrenstechnik:
|
Bei den Reaktoren haben wir also entsprechend:
|
Unter Absatzweisen Reaktoren muß man sich also so eine Art 'Suppentopf ' vorstellen, in den die ganzen Reaktionskomponenten hineingeworfen und vorteilhafterweise noch umgerührt werden. Wenn der Reaktionsfortschritt den gewünschten Zustand erreicht hat, wird irgendwie abgebrochen, das Produkt entfernt und eventeull aufgearbeitet. Die Chemiker sagen da gerne etwas salopp, 'in kleinen 'Klitschen' wird das Zeug halt in einem batch-Reaktor zusammengekübelt und das war's '. Das tut dem batch-Reaktor etwas unrecht, denn er hat die reaktionstechnischen Vorteile der örtlich (fast) vollständigen Rückvermischung und der zeitlichen Nicht-Rückvermischung . Dies wird noch eingehend erläutert werden (müssen) !!
Bei Kontinuierlichen Reaktoren fällt es schwer, ein 'alltägliches' Beispiel aufzuzeigen, denn wer wird schon allzuoft ein Werk der Chemie-Industrie oder eine Raffinerie besichtigen. Mir fällt im Moment als Bestes eine Zementfabrik ein. Sie haben doch sicher schon im Vorrüberfahren an einer Zementfabrik (z.B. Märker in Haarburg/Schwaben) einen der riesigen Drehrohröfen gesehen, riesige rotierende zylindrische Monster. In Drehrohröfen werden die Ausgangsstoffe oben in das Riesenrohr gegeben und wandern dann langsam auf der 'schiefen Ebene' des Rohres durch die Reaktionszone nach unten. Das ganze läuft stetig, sozusagen Tag und Nacht (um es wieder so salopp wie oben zu formulieren: 'bis keiner mehr Zement braucht' !!)
Es gibt absatzweise (batch) verlaufende Reaktionsabläufe in absatzweisen Reaktoren (batch reactors) und kontinuierlich (continuously) verlaufende Reaktionsabläufe in kontinuierlichen (continuous) Reaktoren. Dazwischen liegen Teilfließbetriebe (semi batch) mit verschalteten Reaktoren (reactor combinations) |
An dieser Stelle noch eine Begriffs-Festlegung: dem Reaktionsablauf zugesetzte Einsatzstoffe nennt man 'Edukte', aus der Reaktion erhaltene Stoffe 'Produkte' |
haben Sie es schon gemerkt? Der Autor hat ein Faible dafür, 'sich das Maul zu verreißen':
Merke: In Reaktoren läuft
böse Chemie ab, Reaktoren -das ist ja allgemein bekannt- strahlen immer
und sind eine Art Vorstufe zur Atombombe, - außerdem verpesten sie die
Umwelt mit dem weißen Rauch, der ihnen entsteigt.
(
Für die, die das wirklich 'glauben' ein Versuch, sie von ihrem 'Glauben'
abzubringen: Kernreaktoren sind eigentlich 'Physik-Reaktoren' und keine
'Chemie-Reaktoren', - Reaktoren sind eben einfach Apparate, in denen etwas
reagiert, also ganz grob gesagt 'abläuft'. In Reaktoren der
Chemie-Industrie laufen normalerweise aber chemische Reaktionen und keine
physikalischen Kernspaltungsprozesse ab, sie 'strahlen' deshalb auch eher mal
Wärme ab, aber keine radioaktiven Strahlen. Der weiße Rauch von
Kernkraftwerken ist Wasserdampf von den Kühltürmen, - na ja, in
meinen Augen ist allzuviel Wasser natürlich auch ungesund, das merkt man
spätestens dann, wenn man mit dem Kajak in einem Plumpsklo oder einer
Killerwalze absäuft, dorthin möchte ich gerne die, die das
obengenannte immer noch glauben, gerne mitnehmen, um gemeinsam mit ihnen
'gegen die Bestie Natur zu
kämpfen'. Unter dieser Clientele werde ich dann wahrscheinlch viele
Zeitungsschreiber finden, die ja vor naturwissenschaflichen Kenntnissen
geradezu strotzen (den Beleg hierfür bringe ich Ihnen in dem Abschnitt des
obenzitierten Links)! )
 Dieser
Reaktortyp ist auch dem Laien leicht verständlich, es ist der durch
Rühren oder sonstiges 'Umwälzen' gut durchmischte 'Kochtopf der
Chemie'. Wenn der Chemiker im Labor Reaktionen durchführt, wird er sie
meistens in einem Becherglas mit Magnetrührer oder einem Mehr-(z.B. 3-)
Halskolben mit Rührer oder einer vergleichbaren Anordnung durchfüren.
Dieser 'Reaktor' arbeitet absatzweise, d.h. die Edukte werden zugesetzt, die
Reaktion startet (aus irgendeinem 'chemischen Grund') und 'werkelt' so lange
vor sich hin, bis wir etwas unternehmen. Am Ende wird das Zeugs aus dem Pott
herausgenommen und irgendwie weiterverarbeitet, z.B. durch Kristallisation
gereinigt u.v.a.
Dieser
Reaktortyp ist auch dem Laien leicht verständlich, es ist der durch
Rühren oder sonstiges 'Umwälzen' gut durchmischte 'Kochtopf der
Chemie'. Wenn der Chemiker im Labor Reaktionen durchführt, wird er sie
meistens in einem Becherglas mit Magnetrührer oder einem Mehr-(z.B. 3-)
Halskolben mit Rührer oder einer vergleichbaren Anordnung durchfüren.
Dieser 'Reaktor' arbeitet absatzweise, d.h. die Edukte werden zugesetzt, die
Reaktion startet (aus irgendeinem 'chemischen Grund') und 'werkelt' so lange
vor sich hin, bis wir etwas unternehmen. Am Ende wird das Zeugs aus dem Pott
herausgenommen und irgendwie weiterverarbeitet, z.B. durch Kristallisation
gereinigt u.v.a.
Die Angabe 'ideal' bezieht sich nun auf die Durchmischung
der Reaktionsmasse (z.B. mit Hilfe des Rührers). Die Reaktionsmasse soll
so ideal vermischt sein, daß im Reaktorraum alle Konzentrationen
(Stoffmenge pro Raumeinheit) exakt gleich sind, - ein 'claim' der real
natürlich nie 'tausenprozentig' erreicht wird, - aber immerhin oft recht
gut!! Wie sehen nun die Stoffmengen'profile' im AIK aus. Aufgrund der unendlich
schnellen Vermischung sind die Konzentrationen im AIK zu einem diskreten
Zeitpunkt überall im Reaktionsraum gleich, man sagt der Reaktor AIK sei
'räumlich (konzentrations-)stationär'.
Wie sieht es aber über die ablaufende Zeit aus ? Nun, über
die Zeit laufen die Konzentrationen der Komponenten so ab, wie es ihnen das
'Wesen' der chemischen Reaktion 'befiehlt', - das nennt der Chemiker den
Konzentrationsverlauf der chemischen Reaktion, - dieser wird, wie bereits
erwähnt, durch die chemische Reaktionskinetik beschrieben. Da damit die
Konzentration zeitlich nicht konstant bleibt, sagt man der AIK sei 'zeitlich
(konzentrations-)instationär'.
Fazit: |
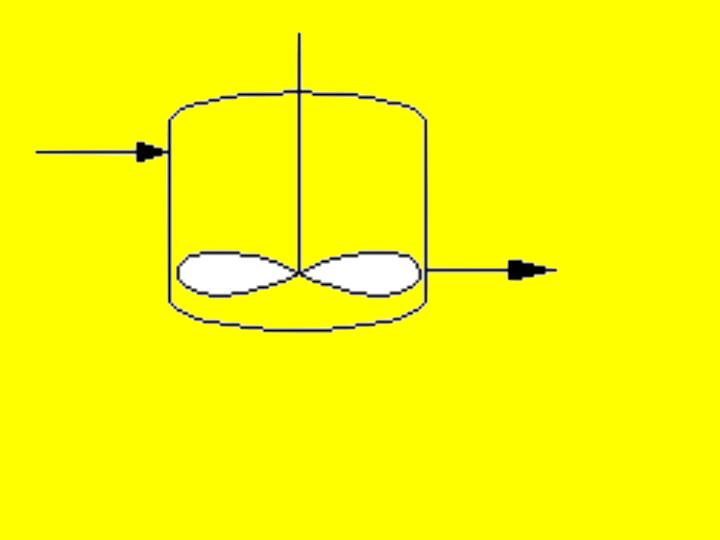 Stellen wir uns einmal vor, eine chemische Reaktion, die wir im Becherglas
haben laufen lassen, soll nun von uns 'kontinuierlich gemacht werden'. Als
'GRIAZ's (größte Ingenieure aller Zeiten) werden wir sicher auf die
Idee kommen, mit einer Dosierpumpe gelöste Ausgangsstoffe (Edukte) in das
Becherglas (den Rührkessel) zufließen zu lassen und vielleicht 'im
Gegenzug' über einen 'Mostheber' (hydrostatische Ablaufvorrichtung) an
einer anderen Stelle den gleichen Mengenstrom abzunehmen, sonst 'läuft das
Ding ja über'. Damit haben wir den kontinuierlichen
Durchflußrührkessel erfunden !! Die Erläuterung des Begriffs
'ideal' ist hier einfach: es soll wieder ein ideal durchmischter
Rührkessel vorliegen.
Stellen wir uns einmal vor, eine chemische Reaktion, die wir im Becherglas
haben laufen lassen, soll nun von uns 'kontinuierlich gemacht werden'. Als
'GRIAZ's (größte Ingenieure aller Zeiten) werden wir sicher auf die
Idee kommen, mit einer Dosierpumpe gelöste Ausgangsstoffe (Edukte) in das
Becherglas (den Rührkessel) zufließen zu lassen und vielleicht 'im
Gegenzug' über einen 'Mostheber' (hydrostatische Ablaufvorrichtung) an
einer anderen Stelle den gleichen Mengenstrom abzunehmen, sonst 'läuft das
Ding ja über'. Damit haben wir den kontinuierlichen
Durchflußrührkessel erfunden !! Die Erläuterung des Begriffs
'ideal' ist hier einfach: es soll wieder ein ideal durchmischter
Rührkessel vorliegen. 

Unsere Erfindung: vom AIK zum
KIK (Achtung Betrug!!!: der Rührer läuft
in Crazy Machines in Wirklichkeit nicht)
Vielleicht sollten wir
uns wieder gleich an dieser Stelle ein paar Gedanken mit unserem 'gesunden
Menschenverstand' zu diesem Apparatetyp machen, - vielleicht prägt das das
Verständnis für unsrere späteren Betrachtungen im voraus. Zuerst
einmal zu der Stoffdurchmischung im Zulauf (also der Edukte) und im Ablauf
(also 'sozusagen' der Produkte). Unter 'ideal' sei hier nämlich auch
gleichzeitig verstanden, daß die zufließenden Edukte mit unendlich
hoher Geschwindigkeit mit der Masse im Reaktionsraum 'Rührkessel'
vermischt werden. Da ja bedingt durch die Chemische Reaktion die Menge pro
Volumeneinheit (d.h. Konzentration) der jeweiligen Edukte im Reaktionsraum
(Rührkessel) niedriger sein wird als im Zulaufstrom, weil das Zeug ja im
Pott miteinander reagiert und damit Edukt verbraucht wird, haben wir an der
Eintrittsstelle einen sogenannten 'Konzentrationssprung'. Ich habe da immer zu
den Studierenden gesagt: 'rein und runter', d.h. sowie die Edukte in den Kessel
kommen, ist ihre Konzentration sofort auf die im Kessel herrschende
niedrigere Konzentration abgesunken. Die Konzentration (jetzt sogar) aller
Stoffe im Auslauf des Kessels sind zeitlich und örtlich gleich, das nennt
man 'örtlich und zeitlich stationär = raumzeitstationär '.
Etwas schwieriger
ist das Verständnis für folgende Eigenschaft des KIK. Bedingt durch
den Volumenstrom durch den Kessel, hat die Reaktionsmasse eine begrenzte
Verweildauer im Reaktionsraum, - und dies 'zu allem Überfluß auch
noch' mit einer Aufenthalts-Wahrscheinlichkeit geprägt, also nicht
diskret, sondern in einer 'Bandbreite', - jedenfalls aber sicherlich nicht so
lange, wie wir im absatzweisen Kessel abwarten können (bis sozusagen
'alles abreagiert hat'), sonst wäre unser Durchflußrührkessel
einfach riesengroß. Das legt den Schluß nahe, daß im
kontinuierlichen Durchflußkessel (KIK) keine so hohen spezifischen
Produktleistungen erhalten werden können. Eine 'sympathische' Eigenschaft
des KIK ist dagegen, daß ja -wie schon ergründet- die
Konzentrationen aller Stoffe im Kessel räumlich und eben aber auch
zeitlich konstant sind. Das spielt für reaktionstechnische und kinetische
Untersuchungen oft eine Rolle, weil meistens stationär anfallende
Messwerte besser oder genauer erfasst werden können.
Wir sagen: |
![]()

------------------------ crazy laboratory tubular flow
reactor = CLTFR ( kein Prüfungsstoff!!)
Der Begriff
'kontinuierlich' wird hier oft weggelassen, - weil 'nichtkontinuierlich' sind
nur 'Anfahrzustände' oder Störfolgen, - ähnliches gilt im
übrigen auch für den KIK, hier wird 'kontinuierlich' aber nicht
weggelassen, zur Unterscheidung vom AIK. Bei Betrachtung der idealen Grundtypen
geht man vom 'sauber eingefahrenen' Zustand aus (hierzu sagt man leider oft
auch der Reaktor sei 'stationär' ).
Vom idealen
Strömungsrohrreaktor wird eine Idealeigenschaft gefordert, die in der
Praxis 'nicht von Pappe' ist. Sie wird im Englischen mit 'plug stream'
bezeichnet, - bei uns mit 'idealer Pfropfströmung'. Im idealen Rohreaktor
soll 'ideale Pfropfströmung' herrschen. Wenn Sie etwas Kenntnisse zur
Hydrodynamik in Fluiden (Strömungslehre) haben, wissen Sie, daß nur
eine turbulente Pfropfströmung nahe an die ideale Pfropfströmung
herankommt, viel häufiger werden in Rohren aufgrund der Randschichthaftung
laminare oder Übergangsströmungen mit axialem Strömungsprofil
auftreten. Als Kanusportler bringe ich da immer das 'Bild' vom Fluß mit
seinen Kehrwässern an der Uferzone.
Halten wir also fest, der
Begriff 'ideal' beim Strömungsrohrreaktor bedeutet ideale
Pfropfströmung, wie sie in der Realität nur angenähert erreicht
werden kann. Wie sieht so eine ideale Pfropfstömung im IR nun aus? Man
muß sich da ein Durchlaufen von infinitesimal dünnen Scheibchen
Reaktionsmasse durch das Rohr vorstellen. Diese Scheibchen haben keinen
Stoffaustausch mit ihrem jeweiligen 'Vorder- oder Hintermann'. Innerhalb des
Scheibchens sind die Konzentrationen gleich. Ein Modell für diese
'Reaktorscheibchen' wäre übrigens der AIK. Man könnte also
sagen, das IR wird von einem Set infinitesimal kleiner AIKs durch'flossen', -
interessant, oder nicht? Kann man da etwa schon erahnen, daß zwischen dem
absatzweisen AIK und dem kontinuierlichen IR mehr 'Verwandtschaft' besteht, als
zwischen den kontinuierlichen Typen IR und KIK? Das bewahrhauptet sich jetzt
gleich, wenn wir uns mit den Konzenztationsverläufen im IR befassen.
Verfolgen wir ein AIK-Scheibchen bei seinem Durchlauf durchs Rohr. Von
Vorrück-Step zu Vorrückstep ist die Reaktion ein wenig weiter
fortgeschritten und zwar genau so, wie wenn wir die zeitliche
Konzentrationsverlaufkurve im AIK auf die Ortskoordinate des Rohrs
'transformiert' hätten. Und genau das ist es !!! Die Transformation ergibt
sich aus dem Volumenstrom und dem Rohrdurchmesser , - anders gesagt, die
Verweildauer des Scheibchens im Rohr (Verweilzeit!!) ist die Reaktionsdauer. Da
nun das Strömungsbild im Rohr konstant ist (stationär), kommen an
gleichen Stellen immer Scheibchen an, die den gleichen Reaktionsfortschritt
aufweisen. Wir erhalten also insgesamt als Konzentrationsverlauf entlang der
Rohrlängenachse den zum zeitlichen Verlauf in einem AIK analogen Verlauf.
Also: der AIK ist räumlich stationär und zeitlich instationär,
das IR ist zeitlich stationär und räumlich entlang der Rohrachse
instationär. Die Konzentrationsverlaufkurven sind über die
Verweilzeit ( Reaktionsdauer im AIK und Reaktorvolumen dividiert durch
Volumenstrom im IR) mit einander verknüpft.
Wir sagen: |
An dieser Stelle möchte ich ihnen das 'Allerweltsbild' zum Konzentrationsverlauf in den 3 Grundreaktortypen nicht vorenthalten. Es findet sich in fast jedem Lehrbuch zur Chemischen Reaktionstechnik. Wer es gut 'verinnerlicht' hat, hat schon 'halber gewonnen'. Die Beschriftung ist zwar Englisch, aber die Begriffe sollten Ihnen inzwischen schon geläufig sein. Versuchen Sie auch mal schon, ohne 'unten' zu spicken, das obenerwähnte aus den Bildern 'herauszuinterpretieren' (bevor wir es im folgenden nochmals tun).
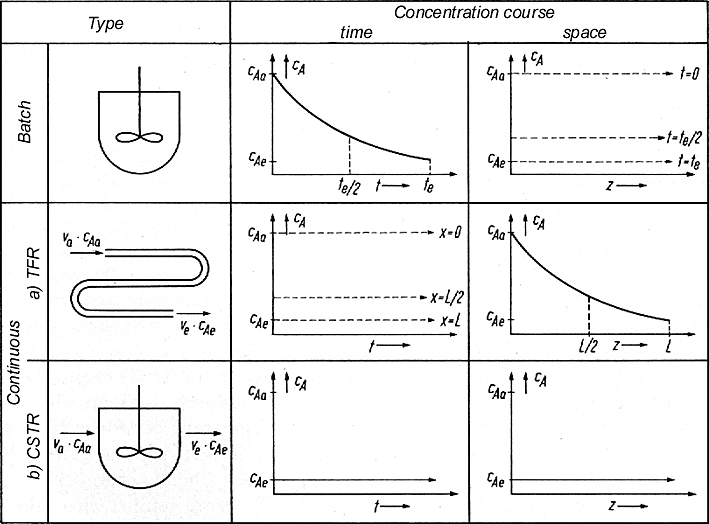
In der Abbildung sind links schematische Skizzen der 3 Reaktortypen. In
der mittleren Spalte sind die zeitlichen Konzentrationsverläufe
dargestellt. In der rechten Spalte sind die örtlichen
Konzentrationsverläufe dargestellt.
Beim AIK ist der
zeitliche Verlauf identisch mit dem Verlauf der reaktionskinetischen
Konzentrations/Zeitkurve. In der räumlichen Auftragung sind die jeweiligen
Kurven mit der Zeit als Parameter waagrechte Parallelen
(ortskonstant)
Beim IR sind die Verhältnisse gerade
umgekehrt wie im AIK. Die rechte Kurve zeigt den Verlauf der Konzentration
entlang der Längenkoordinate des Rohrs, diese lässt sich durch eine
Orts->Zeit-Transformation in die reaktionskinetische
Konzentrations/Zeitkurve (im AIK) umrechnen. In der linken Kurve ist hier der
Ort als Parameter in der Zeitabhängigkeitskurve eingetragen. An einem
diskreten Ort ist die Konzentration zeitlich konstant
(stationär)
Beim raumzeitstationären KIK ist der
Konzentrationsverlauf in beiden Auftragungen konstant und im Wert gleich.
Dieser entspricht dem chemisch bedingten Reaktionsfortschritt unter den
gegebenen Bedingungen und der Wert ist jedenfalls niedriger als der im Zulauf
(merke: rein und runter), dessen Wert mit CAa auf der Y-Achse
markiert ist.
Fazit und Wiederholung: |
Bitte teilen Sie mir mit, wenn ein Interesse am vorliegenden Stoff besteht ! Ganz toll wäre auch, wenn ich auf Fehler aufmerksam gemacht würde.
pdf-Datei des vorliegenden Teils 1 (ca. 460 k), Feb. 2009
weiter zu Teil 2 und: pdf-Datei des Teils 2 (ca. 560k), Feb. 2009
weiter zu Teil 3 und: pdf-Datei des Teils 3 (ca. 700k), Feb. 2009
weiter zu Teil 4 und: pdf-Datei des Teils 4 (ca. 920k), Feb. 2009